|
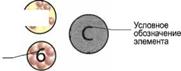
Название |
|
Условное обозна чение |
|
Металлы |
|
AI РЬ Сг |
|
Вольфрам Цинк Олово |
|
W Zn Sn |
|
Fe Au К |
|
Аргон Хлор Фтор |
|
Аг Cl F |
|
Са Со Си |
|
He С Ne |
|
Магний Марганец Молибден |
|
Mg Мп Мо |
|
Натрий Никель Ниобий |
|
Na Ni Nb |
|
Платина Ртуть Серебро |
|
Pt Hg Ag |
|
Тантал Титан Ванадий |
|
Ta Ti V |
|
Si Se |
|
Увеличение |
|
|
|
Медный желоб Атом меди Графит |
|
|
|
Таблица 14.1. Названия и условные обозначения важнейших элементов |
|
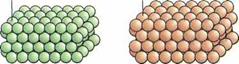
Атомы меди ооооо QOQQG ООООО ООООО Элемент меди Атомы углерода QQGQQQ ОООСЮО COGOOG Элемент углерода |
|
Рис. 14.5. Атом в химических элементах |
|
Алюминий Свинец Хром |
|
Фосфор Кислород Сера |
|
Условное обозна чение |
|
Гелий Углерод Неон |
|
Полуметаллы |
|
Железо Золото Калий |
|
Кремний Селен |
|
Азот Водород |
|
Неметаллы |
|
Название |
|
Металлы |
|
Кальций Кобальт Медь |
|
Рис. 14.6. Модель атома в сравнении величин |
|
Диаметр — головки наконечника |
|
Длина спортивной |
|
Атомная оболочка |
|
Атомное ядро |
|
|
|
Из естественных элементов 66 — металлы, 17 — неметаллы и 6 — полуметаллы. • Металлы блестят и хорошо проводят электрический ток и тепло. • Неметаллы в большинстве случаев газообразные, преимущественно являются изоляторами электрического тока и плохими проводниками тепла, как, например, сера. • Полуметаллы могут иметь как металлические, так и неметаллические свойства, как, например, кремний. Элементы условно обозначаются латинскими и греческими буквами или именами своих первооткрывателей, например Эйнштейний (табл. 14.1). Химические элементы состоят из атомов. Атомы определенного элемента взаимосвязаны между собой, а потому различные свойства элементов получаются из разнообразного состава атомов. АТОМ |
|
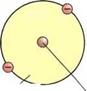
Атомы настолько маленькие, что они невидимы. Поэтому строение атомов и процессы в атоме представили с помощью моделей. Согласно модели датского натуралиста Нильса Бора (1885—1962), атомы имеют шарообразный вид и состоят из электронной оболочки атома и атомного ядра (рис. 14.5). |
|
Диаметр электронной оболочки атома: 0,000 ООО 1 мм = 10-миллионная доля миллиметра, диаметр атомного ядра: 0,000 000 000 001 мм = триллионная доля миллиметра (рис. 14.6). |
|
Мельчайшие частицы материалов, которые физическими или химическими процессами уже больше не делятся, называются атомами. |
|
Протон |
О |
Нейтрон |
|
|
C+J |
электрически |
электрически |
|
|
постоянный |
нейтральный |
||
|
Ядро |
Ядро |
||
|
атома гелия |
* атома углерода |
||
|
С(§Э |
2 протона |
6 протонов |
|
|
ЧБ/ |
2 нейтрона |
6 нейтронов |
|
|
4 нуклона |
12 нуклонов |
|
Рис. 14.7. Строение атомного ядра |
|
Рис. 14.8. Обозначение углерода |
|
|
|
Массовое число ИЛИ ЧИСЛО————— нуклонов 12 Т і /_ |
|
Порядковый номер или атомный |
|
Упрощенное изображение (І) Электрон электрически отрицательный |
|
|
|
Объемное изображение (+) Протон электрически положительный |
|
Нейтрон |
|
|
|
Электронная Атомная оболочка Электрон оболочка Атомное ядро |
|
Рис. 14.9. Модель атома гелия |
|
|
|
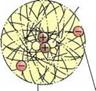
Рис. 14.10. Изображение атомов, имеющих несколько оболочек |
|
АТОМНОЕ ЯДРО • находится в середине атома, • в нем сосредоточена почти • состоит из нуклонов или Нуклоны делятся на: протоны, электрически поло- нейтроны, электрически нейт- Атомные ядра могут состоять Массовое число или число нуклонов = = число протонов и нейтронов в атоме. Порядковый номер или атомный номер = = число протонов в атомном ядре. Атом гелия и, соответственно, ЭЛЕКТРОННАЯ ОБОЛОЧКА Электронную оболочку атома об- Электроны заряжены электри- воположным зарядам электроны удерживаются на своих орбитах. Электроны группируются вплоть до семи электронных оболочек, которые, |
|
При постоянном количестве атомов любого элемента, а именно при 6,02205 • 1023 = 1 моль, относительная атомная масса соответствует своей атомной массе в граммах. |
|
Элемент |
Атомная масса |
Элемент |
Атомная масса |
|
Водород Углерод Азот Кислород Алюминий |
1,008 12,011 14,007 15,999 26,982 |
Кремний Сера Кальций Железо Свинец |
28,086 32,064 40,08 55,847 207,192 |
|
Таблица 14.2. Атомная масса в граммах (примеры) |
|
|
|
Атомное ядро |
|
Нейтроны 6 Протоны 6 |
|
|
|
Атомное ядро |
|
Нейтроны 7 Протоны 6 |
|
|
|
Атомное ядро |
|
Нейтроны 8 Протоны 6 |
|
Нуклоны 14 |
|
Нуклоны 12 Нуклоны 13 Условное обозначение: С12 С13 |
|
С 14 |
|
Рис. 14.11. Изотопы углерода
|
|
внутренней оболочке это 2, на второй 8, на третьей 18, на крайней, тем не менее, соответственно, 8 (рис. 14.10). АТОМНАЯ МАССА При определении атомной массы не учитывается очень незначительная масса электронов. Масса протона водорода, например, составляет 1,67 • 10-24 г. Так как это число очень маленькое, то его заменяют числом 1,008 или 1. Так как масса протона равна массе нейтрона, атомная масса остальных элементов всегда является кратной этому числу. Поэтому ее называют относительной атомной массой (массовое число). Относительная атомная масса атома кислорода с 16 нуклонами составляет 15,999 или 16 (табл. 14.2). ИЗОТОПЫ Атомы определенного элемента, например, углерода, хотя и имеют одинаковое число протонов, однако количество нейтронов может быть разным (рис. 14.11). |
|
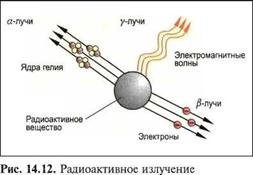
Например, изотопы углерода имеют те же самые химические свойства, но разные массы. Почти все элементы образуют изотопы, но только в очень незначительном объеме. РАДИОАКТИВНОСТЬ Изотопы нескольких элементов, например радия (Ra 226) и углерода (С 14), испускают лучи, при этом атомные ядра распадаются. Это свойство называют радиоактивностью. При этом различают а, (3 и /-лучи (рис. 14.12). а-лучи состоят из ядер атома гелия. Состоящие из электронов /?-лучи, проникают в толщину листа стали или листа свинца до 1 мм. |
|
Атомы определенного элемента с разным числом нейтронов называют изотопами. |
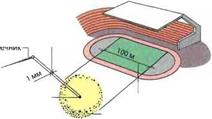
Очень коротковолновые /-лучи возникают при ядерной реакции. Они проникают через бетонные стены толщиной 1 м и могут быть остановлены только толстыми свинцовыми пластинами. Они очень опасны для человека и ведут к разрушениям ткани.
Радиоактивные материалы используют в технике, например для контроля толщины материала при изготовлении бумаги, фольги и металлических листов.
14.1.3.2. Периодическая система элементов
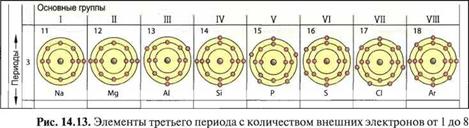
Если рассматривать элементы в последовательности порядковых номеров по их свойствам, то через восемь элементов периодически встречаются элементы с почти теми же свойствами. При таком подходе получается семь строк или периодов. Третий период содержит в себе, например, элементы от натрия до аргона (рис. 14.13).
|
|
Если расположить семь периодов таким образом, что элементы с одними и теми же свойствами стоят друг под другом, то получим восемь вертикальных рядов или основные группы с І по VIII (табл. 14.3).
Расположение элементов по своим свойствам в семи горизонтальных периодах и восьми вертикальных основных группах называют периодической системой элементов (PSE).
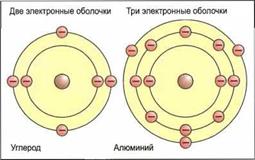
Установлено, что элементы основных групп на внешних оболочках своих атомов имеют соответственно одинаковое число электронов от одного до восьми. Элементы основной группы I имеют, соответственно, 1 внешний электрон. Они являются металлами (кроме водорода) и энергично вступают в реакцию с неметаллами, например с кислородом и хлором. Элементы основной группы VIH имеют восемь внешних электронов. При комнатной температуре они газообразные и не соединяются с другими веществами (благородные газы). Металлы находятся в левой части, неметаллы в правой части периодической системы, между ними расположены полуметаллы. В периодической системе отчетливо видно, что свойства элементов зависят от числа своих внешних электронов.
Атомы элементов групп, расположенных в центре, имеют один или два внешних электрона и отличаются числом электронов на внутренних оболочках. Свойства элементов центральной группы имеют большое сходство, все эти элементы — металлы (табл. 14.3).
|
772 Глава 14. Физико-химические основы и справочная информация Таблица 14.3. Периодическая система элементов (сокращенная)
|
|
14.1.4. Химические соединения |
|
|
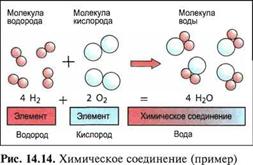
Различные атомы и, соответственно, элементы могут соединяться друг с другом. Возникающее при этом новое вещество называют химическим соединением. Это новое вещество имеет абсолютно другие свойства, чем элементы, из которых оно состоит. Вода (Н20), например, связывает в молекулу один атом кислорода (О) с двумя атомами водорода (Н). Химическое соединение воды имеет свойства, отличные от свойств элементов водорода и кислорода (рис. 14.14).
Молекула является самой маленькой частицей химического соединения.
|
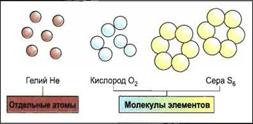
Рис. 14.15. Отдельные атомы и молекулы элементов |
Молекулы химических соединений похожи друг на друга.
У многих элементов определенное число атомов соединяется в молекулы. Это можно назвать молекулой элемента, например кислород с двумя и сера с шестью атомами. Отдельные атомы существуют только у благородных газов, например гелия (рис. 14.15).
|
|
|
— Атом |
|
Атом |
|
Рис. 14.16. Соединения частиц |
|
Элемент натрия Na |
|
Элемент железа Fe |
В металлических элементах атомы образуют кристаллические соединения частиц (рис. 14.16).
Число атомов элемента в молекуле изображается после условного обозначения числом снизу (индексом), причем индекс 1 не пишется.
Примеры:
СН4 одна молекула метана состоит из одного атома углерода и четырех атомов водорода,
NaCI одна молекула хлорида натрия (поваренной соли) состоит из одного атома натрия и одного атома хлора.
В химических соединениях атомы связываются различными способами. Различают образование электронных пар, ионных и металлических связей.




 11 января, 2015
11 января, 2015  Furniturer
Furniturer 
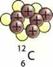
 Опубликовано в рубрике
Опубликовано в рубрике