Оксид углерода (СО) образуется при сгорании углеродистых материалов при недостаточном притоке кислорода. Это бесцветный, без запаха и очень ядовитый газ, который горит с синеватым пламенем. Он используется для промышленного изготовления многих материалов, например пластмасс и растворителей.
Диоксид углерода (С02) образуется при сгорании углеродистых материалов. Это не горючий, без запаха, бесцветный и неядовитый газ. Так как он примерно
1,5 раз тяжелее, чем воздух, то накапливается в более низко расположенных местах, например в подвалах и шахтах. Из-за этого там возникает опасность удушья!
Углекислота (Н2СОз) образуется, если диоксид углерода растворяется в воде. Соли углекислоты являются карбонатами (см. 14.1.9).
Карбиды — это соединения углерода с металлами, например карбид железа (Fe3C), карбид вольфрама (WC), карбид титана (TiC), карбид кальция (СаС2), карбид кремния (SiC) и карбид бора (В4С3). Некоторые карбиды имеют высокую твердость и поэтому используются как шлифовальные материалы и материалы для изготовления режущих кромок.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ УГЛЕРОДА
|
© |
© |
© |
© |
© |
|
®-ф- |
т-@ |
(и) ф |
||
|
© |
© |
© |
© |
© |
|
Этан С2Н0 |
Пропан С3Н8 |
Важные органические соединения углерода — это углеводороды. По их молекулярному строению различают цепные и циклические, а также разветвленные свободные углеводороды. В цепных углеводородах атомы углерода образуют ряды, а валентные связи атомов углерода используются для присоединения атомов водорода (рис. 14.32). Цепочки углеводорода, содержащие до 5 атомов углерода С, являются газообразными, например пропан С3Н8, от 6 до
„ 15 атомов углерода С — жидкими, на-
Рис. 14.32. Углеводород с молекулами цепной J * ’
формы пример октан С8Н18, содержащие от
15 атомов углерода С и больше — от пастообразных до твердых, например ок — тадеан (стеарин) С18Н38. Бензин — это смесь жидких углеводородов. Атомы углерода могут соединяться друг с другом с использованием двух — или трехвалентных связей. Такие углеводороды называют непредельными (ненасыщенными). Примером непредельных (ненасыщенных) углеводородов являются газы, например ацетилен и этилен (рис. 14.33). Самое простое циклическое углеводородное соединение — это бензол С6Н6. Другая образуемая бензолом связь — это фенол С6Н5ОН (рис. 14.34). Циклические и непредельные (ненасыщенные) углеводороды — это важные исходные материалы для химической промышленности, например для изготовления пластмассы.
|
Рис. 14.33. Непредельные (ненасыщенные) углеводороды |
|
|
Следующие органические углеродистые соединения, которые наряду с водородом содержат и другие элементы, например кислород, хлор и азот, являются спиртами, альдегидами, органическими кислотами и хлористыми углеводородами (табл. 14.7).
|
Таблица 14.7. Важные органические соединения углерода
|
|
вода |
|
н2со3 |
|
вода |
|
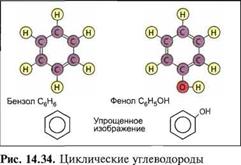
Рис. 14.35. Серная кислота (схематически) |
|
Образование кислоты
|
Кислота состоит из ионов водорода Н+ и ионов кислотного остатка, например SO?~,COf~ или С1~
Общие свойства:
• Кислота разъедает большинство металлов и многие органические вещества
• Кислота на вкус кислая. (Обратите внимание: проба на вкус только при слабой или сильно разбавленной кислоте!)
• Кислота проводит электрический ток
• Кислота окрашивает синюю лакмусовую бумажку в красный цвет!
Пример:
Углекислота Соляная кислота НС1
14.1.7. Кислоты
Кислоты образуются, если оксиды неметаллов растворяются в воде, например углекислота (Н2С03) или серная кислота (H2S04). Также соединения нескольких неметаллов, например хлор (С1) и фтор (F) с водородом (Н), дают в итоге растворенную в воде соляную кислоту (НС1) или фтористоводородную кислоту (HF).
В водном растворе молекулы кислоты расщепляются частично или полностью на ионы водорода Н+ и ионы кислотного остатка, например SO2- (рис. 14.35).
Свойства кислоты проявляются благодаря отделившимся ионам Н+. Поэтому кислота действует только как водный раствор. Сила кислоты зависит от того, как долго удерживаются в растворе агрессивные ионы водорода (табл. 14.8).
Положительно заряженные ионы водорода называют катионами, отрицательно заряженные ионы кислотного остатка — анионами.
2Н+ С032- Н+ С1-
|
Таблица 14.8. Основные кислоты
|
|
©Молекула едкого натра |
|
(от) 0 (^ 0 |
|
Ион натрия Чвр’ (катион) |
|
Рис. 14.36. Раствор едкого натра (схематически) |
|
|
|
© Ион ОН- (анион) |
|
Образование щелочи |
||
|
К20 + |
Н20 |
■> 2КОН |
|
оксид |
вода |
раствор едкого калия |
|
калия |
(гидроокись калия) |
|
|
Оа + |
н2о———— |
► Са(ОН)2 + H21Т |
|
кальции |
вода |
гидрооксид кальция водород (гашеная известь) |
|
Щелочи состоят из ионов металлов и гидроок- |
||
|
сидов-ионов (ОН-группы). |
|
Свойства: |
|
• Щелочи разъедают некоторые металлы, например свежий раствор алюминия. • Щелочи являются жирорастворяющими веществами и разъедают растительные и животные жиры. • Щелочи разъедают кожу и разрушают одежду. • Щелочи на ощупь мыльные. • Щелочи окрашивают красный лакмус в синий цвет. |
|
14.1.8. Щелочи Щелочи образуются в растворах Если газ аммиак NH3 растворя- Выпариванием щелочей полу- Гидрооксиды металлов рас- В значительной степени свойства щелочей определяются ионами ОН-, при- Пример: Гашеная известь Са(ОН)2 ————- ——► Са2+20Н“ |
|
Наименование |
Свойства |
Применение |
|
Дубильная кислота |
В присутствии железа и солей железа служит причиной появления темных пятен в древесине |
В виде раствора в горячей воде как предварительная окраска Виды: танин, пирогаллол, пирокатехин, катеху (дубильный экстракт) |
|
Фтороводород HF |
Разъедает кварц и стекло, очень ядовит, разъедает кожу |
Матирование стекла |
|
-у> |
Осторожность в обращении с кислотой и щелочами!
Кислоты и щелочи разъедают кожу, а также слизистые оболочки! Они разрушают одежду!
Кислоты в большинстве случаев ядовиты!
Обратите внимание: кислоты и щелочи опасны, они могут сохраняться только в бутылках с отчетливой маркировкой, не в бутылках для напитков!
|
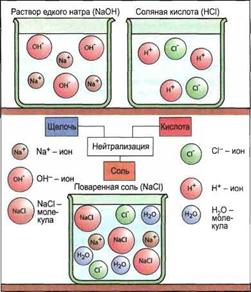
PH — ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ Часто бывает необходимо установить, насколько сильный раствор является кислым или щелочным. Мера для этого — величина pH. Дистиллированная вода имеет величину pH 7. Растворы с величиной pH от 0 до 7 — кислые, от 7 до 14 — щелочные. Величину pH раствора определяют с помощью лакмусовой бумаги или индикаторных растворов, а также при помощи электрических устройств (рис. 14.37). 14.1.9. Соли Соли состоят из ионов металлов и ионов кислотного остатка. Например, в соли сульфат меди (CuS04) ион меди Си2+ связан с ионом кислотного остатка SO2-. Соли возникают при реакции нейтрализации между кислотой и щелочью. При этом действие кислоты и действие щелочи взаимно нейтрализуется (рис. 14.38). |
Надеть защитную одежду и защитные очки!
|
Наименование |
Свойства |
Применение |
|
Нашатырный спирт (NH4OH) |
Резкий неприятный запах, жирорастворяющий, размачивает органические вещества |
Копчение древесины дуба, дополнитель к красителю (морилке) окончательного нанесения приводит к усилению цвета, удаление старого покрытия |
|
Гидрооксид кальция (Са(ОН)2) |
Разъедает металлы, особенно алюминий |
Вяжущее средство для изготовления известкового раствора, предназначено как известковое молоко для нанесения покрытий |
|
Сильная кислота Нейтраль Сильная щелочь pH — водородный показатель п pH — водородный показатель |
|
Таблица 14.9. Основные щелочи |
|
Ш |
Возрастающая кислотность Возрастающая щелочность Дистиллированная
Рис. 14.37. Шкала pH — водородного показателя
|
|
|
Рис. 14.38. Поваренная соль (схематично) |
Кроме того, соли образуются при реакции кислоты с металлом или оксидом металла, а также непосредственно из металла и неметалла.
|
Образование солей |
|
NaOH |
+ |
HCI |
—— ► |
NaCl + |
н2о |
|
раствор |
соляная |
хлорид |
вода |
||
|
едкого |
кислота |
натрия |
|||
|
натра |
|||||
|
Zn |
+ |
HCI |
—- ► |
ZnCI2 + |
н2 |
|
цинк |
соляная |
хлорид |
водород |
||
|
кислота |
цинка |
||||
|
СиО |
+ |
H2S04 — |
—— ► |
CuS04 + |
н2о |
|
оксид |
серная |
сульфат |
вода |
||
|
меди |
кислота |
меди |
|||
|
2 Na |
+ |
CI2 — |
—- ► |
2NaCI |
|
|
натрий |
хлор |
хлорид натрия |
Соль расщепляется в водном растворе частично или полностью на ионы металлов и ионы кислотного остатка.
Соль, растворенная в воде, при испарении воды образует кристаллы.
Химическое обозначение соли содержит обозначение участвующих в ее образовании кислот и металлов (табл. 14.10 и 14.11).
Примеры:
Поваренная соль NaCl ————— —> Na+ Cl-
вода
Сульфат меди CuS04 ————- ► Cu2+ SO2-
|
Таблица 14.10. Обозначение солей
|
|
Таблица 14.11. Основные соли
|
Большинство солей не вступают в реакцию, то есть их раствор не окрашивает лакмус.
Однако растворы соды (Na2C03), углекислого натрия (К2С03) и буры (Na2B407) действуют как щелочные, а раствор сульфата алюминия (A12(S04)3) действует как кислотный.
|
Кисло""" |
|
|
|
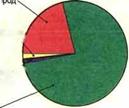
Рис. 14.39. Состав воздуха |
14.1.10. Воздух
|
Благородные, газы i Диоксид ^ ’ углерода Азот |
Земля окружена слоем воздуха, атмосферой. Наверху воздух становится все более разряженным и переходит на высоте примерно 500 км в свободное космическое пространство.
При температуре 0°С и нормальном атмосферном давлении 1 м3 воздуха весит 1,29 кг. Воздух — это смесь различных газов. Он систоит из 21% кислорода, 78% азота, 0,9% благородных газов (аргон, гелий) и 0,03% диоксида углерода
(рис. 14.39). Помимо этого, воздух содержит водяные пары, в зависимости от месторасположения происходит сильное или слабое загрязнение воздуха пылью и выхлопными газами.
Воздух несет несколько функций.
• Для людей, животных и растений он является необходимым веществом для жизни — дыхание.
• Для химической промышленности — как сырье для добычи кислорода, азота и благородных газов.
• Кроме того, он необходим для сгорания веществ.




 12 января, 2015
12 января, 2015 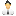 Furniturer
Furniturer 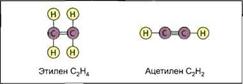

 Опубликовано в рубрике
Опубликовано в рубрике