В дисперсии очень маленькие частицы вещества тонко распределяются в жидкости, не растворяясь в ней. Эту жидкость называют дисперсной средой. Если в жидкости тонко распределены частицы твердого вещества, то говорят о суспензии, например бетонит (рис. 14.24), если это частицы жидкости, то говорят об эмульсии, например битумная эмульсия (рис. 14.25). В дисперсиях мелко раздробленные частицы оседают, и наступает постепенное разделение, поэтому их до применения встряхивают и взбалтывают. Примером являются дисперсионные клеи, например клей ПВА и дисперсионные краски.
|
|
14.1.6. Основные вещества и их соединения
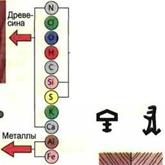
Большинство производственных материалов — это смеси из различных химических соединений, которые, в свою очередь, состоят из элементов (рис. 14.27).
|
|
|
Пластмассы |
|
|
Рис. 14.27. Производственные материалы и их элементы
Фотосинтез
Дыхание, сжигание
|
Рис. 14.28. Возврат кислорода
|
14.1.6.1. Кислород (О) Свойства: кислород — это газ без цвета и запаха, тяжелее, чем воздух. Он необходим как для горения, так и для дыхания, однако сам является горючим. В чистом кислороде сгорают многие вещества и металлы, быстро и очень сильно.
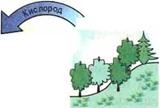
Происхождение: около 21 % воздуха составляет свободный кислород. Большая часть кислорода в связанном виде содержится в горных породах земной коры и в воде. Благодаря фотосинтезу из диоксида углерода растениями выделяется кислород (рис. 14.28).
ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ
Если вещество соединяется с кислородом, то говорят об окислении, возникающее при этом химическое соединение называется оксидом. При каждом окислении выделяется свободное тепло. Окисление по времени может протекать по-разному (табл. 14.6). Если из оксида извлекают кислород, говорят о восстановлении. Для восстановления требуется тепло. Добыча многих металлов из руд происходит благодаря восстановлению.
|
Таблица 14.6. Процессы окисления
|
Свойства: водород — это бесцветный газ, не имеющий запаха, он является самым легким из всех газов, масса 1 л водорода при нормальных условиях равна 0,09 г. Смесь водорода и кислорода в отношении 2 : 1 является высоковзрывчатой (гремучий газ).
Происхождение: водород в чистом виде в природе не встречается, но в виде соединений встречается во многих ископаемых и в воде. Необходимый для промышленности водород производится из нефти или природного газа.
|
Разложение пероксида водорода свет |
|
2Н2°2 пероксид водорода |
|
■+ кислород |
|
Как диоксид (С02) в воздухе |
|
Растворенный в воде |
|
В растениях и животных (биомасса) |
|
Рис. 14.29. Углерод в природе |
|
|
|
|
|
Резиновая шина |
|
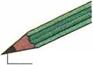
Графит Карандаш |
|
|
|
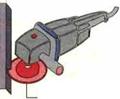
Алмаз Отрезной диск |
|
Сажа |
|
Алмаз |
|
|
|
Породный бур |
|
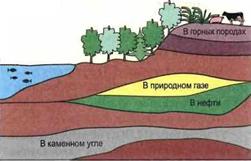
ПЕРОКСИД ВОДОРОДА Пероксид водорода (Н202) — бесцветный и жидкий в чистом состоянии. При дневном освещении он разлагается со взрывом на кислород и воду и поэтому должен сохраняться всегда в прохладном месте в коричневых стеклянных бутылках. Пероксид водорода используется для осветления древесины. 14.1.6.3. Углерод (С) Происхождение: углерод встречается в чистом виде в природе как графит и алмаз. В виде соединений он имеется в горных породах земной коры, например в известняке (СаС03), и содержится в растительных остатках, например в угле, нефти и природном газе. Наряду с этим он — составная часть биомассы растений и животных. Как диоксид углерода (С02) он имеется в воздухе, а также растворен в воде (рис. 14.29). Свойства: графит — это мягкий, блестящий и темно-серый материал. Алмаз — бесцветный, прозрачный, очень твердый и хрупкий. Применение: технически произведенный углерод служит коксом для добычи железа, сажей в производстве резины, как волокна углерода для усиления пластмасс, как алмаз для бурения горных пород и |
|
2НгО вода |
для резки материалов. Алмаз в форме порошка используется как шлифовальный материал, например для отрезного диска, а также для полировки материалов (рис. 14.30).
|
Рис. 14.31. Различные соединения углерода |
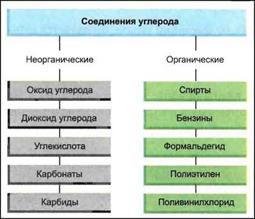
СОЕДИНЕНИЯ УГЛЕРОДА
Различают неорганические и органические соединения углерода. К неорганическим соединениям относятся оксид углерода (СО), диоксид углерода (С02), углекислота и ее соли, а также карбиды, все остальные — это органические углеродистые соединения (рис. 14.31).




 12 января, 2015
12 января, 2015  Furniturer
Furniturer 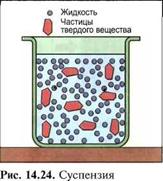

 Опубликовано в рубрике
Опубликовано в рубрике